Wasser kann verschiedene Aggregatszustände (fest, flüssig, gasförmig) annehmen. Im langen Übergang von der flüssigen zur gasförmigen Phase liegt die Dampfphase. Man unterscheidet zwischen
- siedendem Wasser (die ersten Wasserdampfblasen bilden sich),
- nassem Dampf (es hat Wasser und Dampf) bis zum
- Sattdampf (der letzte Wassertropfen verdampft) und den
- überhitzten Dampf (es gibt nur noch Dampf ) .
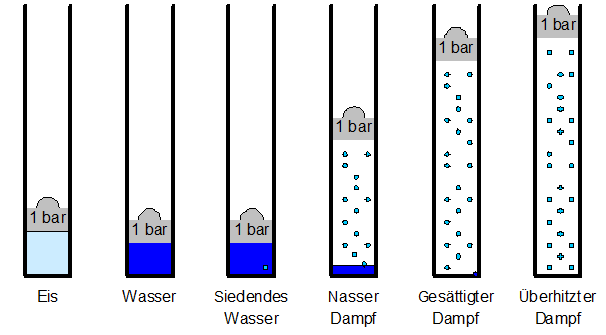
Bei Wasser ist die Volumenzunahme bei der Verdampfung extrem gross. Bei Atmosphärendruck benötigt 1 kg Wasser 1 Liter Volumen, 1 kg Sattdampf aber 1670 Liter Volumen.
Die erforderliche Energie zur Veränderung des Aggregatszustandes bei Wasser ist in untenstehender Grafik dargestellt. Man kann sich vorstellen, dass man 1 kg Wasser kontinuierlich eine Heizleistung von 1 kW zuführt und die Temperatur über die Zeit aufzeichnet. Bei 1 bar Druck (Atmosphärendruck bei 100 m ü. M.) kocht das Wasser bei 100 °C, bei 2 bar erst bei 120 °C und bei nur 0.5 bar (5500 m ü. M.) schon bei 81 °C.
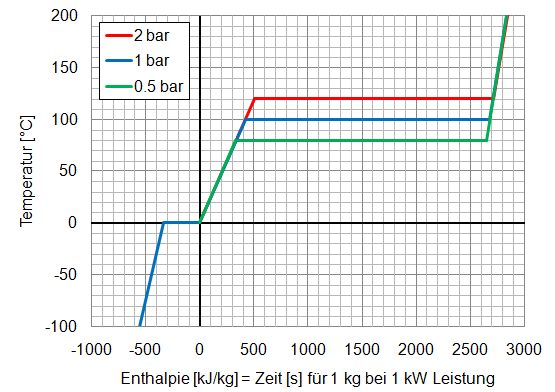
Die zugeführte Energie bezeichnet man als Enthalpie kJ/kg. Die Erwärmung von 1 kg Wasser auf 100 °C dauert 418 Sekunden. Bis dann alles Wasser verdampft ist, dauert es weitere 2230 Sekunden. Die Überhitzung des Dampfes auf 200 °C geht dann schneller als im flüssigen Zustand. Wenn sich durch Energiezufuhr die Temperatur verändert spricht man von sensibler (fühlbarer) Wärme, wenn sich die Temperatur nicht ändert, nennt man sie latente (verborgene) Wärme. Je höher der Druck ist, desto höher ist die Siedetemperatur. Die genauen Zahlenwerte sind in der Dampftabelle zu finden.
Faustformel: Für 1 kg Sattdampf pro Stunde braucht man eine Leistung von 1 PS (736 Watt).

